Las hemoglobinopatías es un tema que, aunque no nos demos cuenta, está presente en nuestro día a día mediante los medios de comunicación. Se está investigando cómo curarlas o cómo evitarlas, y esto es algo sobre lo que se trabaja en la actualidad. En este punto de investigación, tiene un papel fundamental la genética y como ciencia joven que es, podemos decir que está en auge toda la investigación que se realiza en torno a ella para el estudio de numerosas enfermedades.
A continuación os presento un par de noticias que he seleccionado para compartir con vosotros la importancia de la genética en el estudio de enfermedades y cómo nos puede dar la clave para su prevención y si tratamiento.
PERIÓDICO 'ABC' 14 de Abril de 2015.
La edición de genes ofrece una curación para algunos trastornos de la sangre.
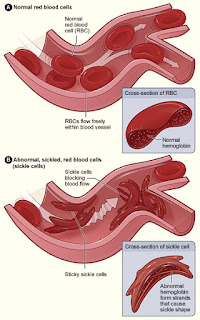
Actualmente no existe tratamiento para la anemia de células falciformes, por lo que estos resultados son muy esperanzadores.
Investigadores del NSW de Australia han demostrado que el cambio de una sola letra del ADN de los glóbulos rojos de la sangre humana aumenta su producción de la hemoglobina que transporta el oxígeno, un avance que podría conducir a una cura para la anemia de células falciformes y otros trastornos de la sangre .
La nueva técnica de edición del genoma, en el que se introduce una mutación genética de origen natural beneficiosa en las células, funciona mediante la activación de un gen durmiente, que sí está activo en el útero pero se encuentra apagado en la mayoría de personas después del nacimiento. «Estamos en una era fascinante con la edicción del genoma», señala Merlin Crossley, y ahora ya podemos «cortar y reparar con precisión genes». Y, añade, nuestro estudio proporciona una «prueba de concepto de que cambiar una sola letra del ADN en un gen podría aliviar los síntomas de la anemia de células falciformes y talasemia». Y, además, debido que la variación genética introducida ya «existe», este enfoque debe ser «eficaz y seguro», aunque reconoce que se necesita más investigación antes de que pueda ser probado en personas como una posible cura para enfermedades graves de la sangre. El estudio se publica en la revista «Nature Communications».
Las personas producimos dos tipos diferentes de hemoglobina. «Durante la fase de desarrollo en el útero, el gen de la hemoglobina fetal está activado. Esto produce la hemoglobina fetal, que tiene una alta afinidad por el oxígeno, lo que permite al bebé a extraer el oxígeno de la sangre de su madre», explica Crossley. Sin embargo, después de nacer, «el gen de la hemoglobina fetal se apaga y se enciende el de la hemoglobina adulta».
Las mutaciones que afectan a la hemoglobina adulta se encuentran entre los más comunes de todas las mutaciones genéticas humanas, ya que se calcula que alrededor del 5% de la población mundial es portadora de un gen de la hemoglobina adulta defectuoso. Las personas que heredan dos genes mutantes -uno de su madre y uno de su padre- sufren enfermedades mortales como la anemia de células falciformes y la talasemia, que requieren tratamiento de por vida con transfusiones de sangre y medicamentos.
Gen de la hemoglobina
Los investigadores han basado su nuevo enfoque en el hecho de que un pequeño número de personas con daño en la hemoglobina adulta tiene una mutación adicional, beneficiosa, en el gen de la hemoglobina fetal. «Esta mutación beneficiosa mantiene su gen de la hemoglobina fetal encendido para el resto de su vida y reduce los síntomas de manera significativa», dice Crossley.
Los investigadores introdujeron esta mutación de una sola letra en los glóbulos rojos humanos mediante la edición de genes. «Las roturas en el ADN pueden ser letales para las células, por lo que tienen la maquinaria construida para reparar cualquier daño lo más pronto posible», señala Crossley. Y nosotros hemos aprovechado este efecto. «Cuando nuestra proteína de edición genoma corta el ADN, la célula rápidamente lo reemplaza con el ADN de los donantes que también hemos proporcionado».
La técnica, si finalmente muestra que es eficaz y segura, ofrecería ventajas significativas sobre otros enfoques, como la terapia génica convencional, en la que los virus se utilizan para transportar genes sanos celda para reemplazar el gen defectuoso.
http://www.abc.es/salud/noticias/20150514/abci-genes-anemia-edicion-201505141306.html
PERIÓDICO 'LA VANGUARDIA' 04 de Abril de 2016
El Hospital La Fe, líder europeo en trasplantes de sangre de cordón en pacientes adultos.
El centro ha realizado cerca de 400 intervenciones hasta 2016, según ha informado la Generalitat en un comunicado.
El Hospital Universitari i Politècnic La Fe de Valencia es, junto con las universidades de Tokio y Minnesota, uno de los tres centros mundiales con mayor experiencia en trasplante de sangre de cordón umbilical en adultos, ya que ha realizado cerca de 400 hasta 2016, según ha informado la Generalitat Valenciana en un comunicado.
La media anual se sitúa en 30 trasplantes en adultos y dos pediátricos. En cuanto a trasplantes de sangre periférica y médula ósea, las cifras se sitúan entre los 120 trasplantes en adultos cada año y 25 en niños.
El trasplante de sangre de cordón umbilical permite trasplantar a casi todos los pacientes que lo precisan --más del 90 por ciento--, aquellos en los que no se dispone de un donante familiar HLA-idéntico, ya que no requiere una compatibilidad completa con el receptor y, además, está disponible de forma inmediata, ya que está almacenada congelada, tras su obtención en el momento del parto.
Referencia mundial
La directora médica del Hospital La Fe, la doctora Mª Jesús Arilla, ha destacado estas cifras en la apertura de la Jornada del Paciente, la Familia y el Donante de Médula Ósea, celebrada en La Fe. "Ser el tercer centro de referencia a nivel mundial sitúa a este hospital en un umbral de exigencia muy alto, se trabaja duro por mejorar estas cifras, la calidad de vida de los pacientes y por seguir avanzando en las técnicas de diagnóstico y tratamiento de las enfermedades de la sangre", ha indicado.
Asimismo, el director general de Investigación, Innovación, Tecnología y Calidad de la conselleria de Sanitat Universal i Salut Pública, Óscar Zurriaga, ha destacado "la importancia creciente de dar voz a los pacientes y sus familias. Poder poner en relación a pacientes con los profesionales para poner en común las preocupaciones, los avances en calidad de vida y en tratamientos permite implicar aún más a los pacientes en sus cuidados y a los profesionales en preocupaciones de las familias".
Trastornos congénitos
Tal y como ha destacado el director del Área Clínica de Oncohematología de La Fe, el doctor Miguel Ángel Sanz, "el uso del trasplante de sangre de cordón está indicado en múltiples enfermedades, incluyendo trastornos congénitos benignos, como talasemia, inmunodeficiencias graves y enfermedades de depósito, aplasia medular grave y, fundamentalmente, neoplasias hematológicas, como leucemias, síndrome mielodisplásicos, linfomas".
Con el fin de abordar estos y otros aspectos del trasplante, el Hospital La Fe ha acogido la décima edición del Día del Paciente, la Familia y el Donante de Médula Ósea, que ha incluido sesiones sobre trasplante de progenitores hematopoyéticos, descripción del proceso de trasplante, cuidados de Enfermería y en casa, investigación en trasplante, y temas de mayor actualidad como la preservación de fertilidad, dilemas éticos en el trasplante de células de sangre de cordón y aspectos sociales, psicológicos y educativos de los pacientes trasplantados.
La jornada concluye con el testimonio de dos pacientes trasplantados. Uno de ellos es Maarten van der Weijden, de Holanda, superviviente de leucemia y ganador de la medalla de oro en los Juegos Olímpicos de Pekín 2008 en categoría de maratón de natación en aguas abiertas.
Congreso anual de trasplante de médula
Valencia acogerá entre el 3 y el 6 de abril el Congreso Anual de la Sociedad Europea de Trasplante de Médula y Sangre (European Society for Blood an Marrow Transplantation, EBMT), según han apuntado en el comunicado.
Este encuentro ha sido organizado por el equipo de Oncohematología del Hospital La Fe, la EBMT y asociaciones de pacientes y acogerá a más de 4.500 asistentes de todo el mundo, especializados en medicina, enfermería, farmacia, pediatría, terapia celular o gestión clínica directamente relacionados con el trasplante de médula ósea o sangre de cordón umbilical.
El director del Área Clínica del Oncohematología del Hospital La Fe y presidente del Congreso EBMT 2016, el doctor Miguel Ángel Sanz, ha destacado que "el objetivo de este foro es permitir intercambiar experiencias y aprender unos de otros. Es una gran oportunidad para estar al día de los últimos avances de investigación en el campo del trasplante de médula y sangre periférica de mano de los especialistas mundiales más relevantes, ha señalado.
En este sentido, el hematólogo de La Fe, el doctor Guillermo Sanz, ha puesto de relieve los avances que se están llevando a cabo, en el campo de la inmunoterapia, con el empleo de linfocitos T modificados, anticuerpos monoclonales y fármacos que estimulan el sistema inmune y permiten eliminar las células tumorales.
Notable resultados
También ha destacado los "notables resultados preliminares que se están obteniendo con donantes haploidénticos y el uso, en trasplante de cordón umbilical, de procedimientos de expansión ex vivo de células madre que permitirán mejorar sus resultados y aumentar el acceso al trasplante a pacientes que lo precisen", ha subrayado.
Por su parte, la presidenta del grupo de Enfermería Pediátrica y Enfermera de Trasplantes en La Fe, Eugenia Trigoso, ha explicado que "la relevancia de La Fe ha quedado patente en la organización de este encuentro, aportando experiencia de referencia a nivel estatal, con una media de 2-3 trasplantes pediátricos de sangre de cordón umbilical cada año y unos 25 de médula ósea".
Trigoso ha añadido que "todos los pacientes trasplantados precisan unos cuidados específicos y los congresos anuales nos permiten actualizar la peculiaridad de los cuidados y mejorar la atención".
La EBMT es una organización médica y científica sin ánimo de lucro fundada en 1974. Está dedicada a la lucha contra el cáncer en sangre y sus enfermedades, así como a mejorar la vida de los pacientes. Son miembros de la EBMT más de 4.000 médicos, enfermeras, científicos y profesionales de la salud e investigación, que trabajan en redes colaborativas de trasplantes de médula ósea y sangre periférica. Engloba a más de 600 centros relacionados con estas enfermedades en más de 60 países de todo el mundo.
La EBMT tiene un papel central como coordinadora del trabajo cooperativo y el conocimiento, centrado en el aumento de la supervivencia y la calidad de vida de los pacientes con tratamientos de cáncer y enfermedades de la sangre.
http://www.lavanguardia.com/vida/20160404/40864342556/el-hospital-la-fe-primer-centro-europeo-lider-en-trasplantes-de-sangre-de-cordon-en-pacientes-adultos.html